- Startseite
- Forschung
- Kontraktionskopplung und Calcium-Signaling
- Cluster für Biologie des Leukozyten
- Cluster Wachstumsfaktoren des pulmonal-vaskulären Remodellings
- Immunzellantwort in kardiovaskulären Erkrankungen
- Inflammation im Rahmen der Herzinsuffizienz
- Strukturelle Herzerkrankung
- Klinische Kardiologie und Intensivmedizin
- Arbeitsgruppe Herzinsuffizienz
- Kardiale Zellersatz- & translationale Herzinsuffizienztherapie
- Elektrophysiologie
- Kontraktionskopplung und Calcium-Signaling
- Kardiovaskuläre Epidemiologie des Alterns
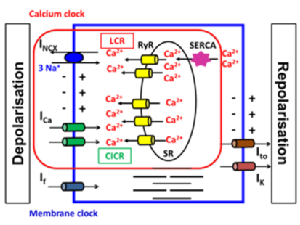
Stellenwert des Natrium-Calcium-Austauschers auf die Sinusknotenaktivität
Kardiovaskuläre Erkrankungen sind weltweit die häufigste Todesursache. Neben den bekannten Erkrankungen wie Myokardinfarkt und Herzinsuffizienz, sind auch Erkrankungen des Sinusknotenlebensbedrohlich. Aufgrund bradykarder Herzrhythmusstörungen wurden in Deutschland im Jahr 2014 76.169 Herzschrittmacher neu implantiert (AQUA Institut, Erfassungsjahr 2014). Die häufigste Indikation stellte mit 28.104 Neuimplantationen (36,9%) das Sick-Sinus-Syndrom dar (Sinusbradykardie, Sinusarrest, sinu-atrialer Block, bradykardes Vorhofflimmern, Tachy-Bradykardie-Syndrom). In den vergangenen Jahren wurde auch für Patienten mit Herzinsuffizienz die prognostische Bedeutung einer Reduktion der Herzfrequenz belegt und somit der Stellenwert einer Schrittmachermodulation auch für dieses Krankheitsbild aufgezeigt.
Allerdings ist die Physiologie spontaner Schrittmacheraktivität im Sinusknoten bislang nicht vollständig verstanden. Über die letzten 20 Jahre gab es die vorherrschende Hypothese, dass die Schrittmacherfunktion durch einen durch Hyperpolarisation aktivierten Nukleotid-gesteuerten Ionenkanal, den sogenannten „funny-channel“ (If), induziert wird. Bei diesem Mechanismus, der auch als „membrane clock“ Hypothese bezeichnet wird, korreliert die Entstehungsrate der Aktionspotentiale mit der Aktivierungskinetik des If, was zu einer Membrandepolarisation führt. Durch sympathische und parasympathische Agonisten und Antagonisten kann die Aktivität des If beeinflusst werden.
Während des vergangenen Jahrzehnts ist eine zweite, konkurrierende Hypothese entstanden, die “calcium clock” Hypothese. Diese Hypothese führt die Sinusknotenaktivität auf spontane lokale Calcium-Freisetzungen (LCR) über Ryanodinrezeptoren in den subsarkolemmalen Raum zurück. Diese Freisetzungskanäle werden in der Membran des sarkoplasmatischen Retikulums gefunden, welches einen wichtigen Calcium-Speicher in Sinusknotenzellen darstellt. Die LCRs sind spontan und benötigen insbesondere keine Membrandepolarisation. Allerdings lassen neueste Ergebnisse darauf schließen, dass die Calcium-Uhr über die Calcium-abhängige Regulation von sarkolemmalen Ionenkanälen und Transportern an die Plasmamembran gekoppelt ist.
Diese Erkenntnisse führten zu einer neuen Hypothese, der sogenannten "gekoppelten Uhr", welche in den Sinusknotenzellen eine normale Schrittmacherfunktion in der engen und komplexen Zusammenarbeit von beiden Uhren sieht. Es wird angenommen, dass der Natrium-Calcium-Austauscher (NCX) das Bindeglied zwischen der „membrane clock“ und der „calcium clock“ bildet.
Schwerpunkt unserer Arbeitsgruppe ist die umfassende Untersuchung zum Stellenwerte des Natrium-Calcium-Austauschers für die spontane Aktivität der Sinusknotenzelle. Diese Fragestellung wird u.a. an einer speziellen NCX1-Knockout-Mauslinie vom embryonalen (Beginn der Aktivitätsabnahme des NCX) bis zum adulten Entwicklungsstadium untersucht.
Erkenntnisse aus dieser Arbeit sollen zum tieferen Verständnis spontaner Schrittmacheraktivität beitragen. Dies könnte die Basis für eine gezielte Optimierung medikamentöser oder möglicher neuer Therapien wie beispielsweise der Zellersatztherapien (Generierung eines zellulären Schrittmachers) darstellen.
Groenke S, Larson ED, Alber S, Zhang R, Lamp ST, Ren X, et al. Complete atrial-specific knockout of sodium-calcium exchange eliminates sinoatrial node pacemaker activity. PLoS One 2013; 8(11): e81633
DiFrancesco D. The role of the funny current in pacemaker activity. Circ Res. 2010; 106: 434-46
Lakatta EG, Maltsev VA and Vinogradova TM. A coupled SYSTEM of intracellular Ca2+ clocks and surface membrane voltage clocks controls the timekeeping mechanism of the heart's pacemaker. Circ Res. 2010; 106
Vinogradova TM, Zhou YY, Maltsev V, Lyashkov A, Stern M and Lakatta EG. Rhythmic ryanodine receptor Ca2+ releases during diastolic depolarization of sinoatrial pacemaker cells do not require membrane depolarization. Circ Res. 2004; 94: 802-9
Stellenwert des Natrium-Calcium-Austauschers für die diabetische Kardiomyopathie
Herzinsuffizienz, ausgelöst durch einen Myokardinfarkt, eine Myokarditis oder systemische Gefäßveränderungen z.B. Sklerosen, ist eine weitere kardiovaskuläre Erkrankung, die lebensbedrohlich ist und zum Tode führen kann. Ursachen kann neben Alter, Blutdruck, Gewicht und Cholesterinwerte auch die Zuckerkrankheit, Diabetes mellitus, sein. So scheinen bei Diabetes mellitus direkte zelluläre Veränderungen für die Entwicklung der Herzinsuffizienz von Bedeutung zu sein und die diabetische Kardiomyopathie eine eigene Entität im Formenkreis der Herzinsuffizienzen darzustellen. Dabei konnte für beide Formen der Zuckerkrankheit, sowohl dem Insulin-abhängigen Typ 1-Diabetes als auch dem nicht Insulin-abhängigen Typ 2-Diabetes die frühzeitige Entwicklung einer Pumpfunktionsstörung und ventrikulären Hypertrophie nachgewiesen werden. Ergebnisse einiger Studien am Tiermodell konnten die zentrale Bedeutung einer veränderten Calcium-Regulation für die Entstehung dieser kontraktilen Dysfunktion bei Diabetes mellitus nachweisen, welche auf spezifische Veränderungen in der Expression und Funktion Calcium-regulierender Proteine der Herzmuskelzelle zurückzuführen sind. Dabei ist die Aktivität des sarkolemmalen Na+- Ca2+- Austauschers frühzeitig vermindert. Bereits 2 Wochen nach Diabetes-Induktion durch Streptozotocin zeigte sich in isolierten Membranvesikeln eine Abnahme der Na+- Ca2+- Austauscher-Aktivität um 44%. Funktionell dürfte die verminderte Expression und Aktivität des Na+- Ca2+- Austauschers bedeutsam für die erhöhten diastolischen und wahrscheinlich auch für die reduzierten systolischen intrazellulären Ca2+-Spiegel des diabeteskranken Herzen sein.
Interessanterweise ist die Expression des Na+- Ca2+- Austauschers bei der Herzinsuffizienz des Menschen und anderen Tiermodellen im Gegensatz zur diabetischen Kardiomyopathie um 79% bis 93% erhöht und funktionell sogar um das 2- bis 3-fache gesteigert. Es gibt Hinweise, dass diese erhöhte Dichte des Na+- Ca2+- Austauschers durch vermehrten systolischen Ca2+-Einstrom und diastolischen Ca2+-Ausstrom einen günstigen Einfluss auf die Ca2+-Regulation bei Herzinsuffizienz haben könnte und somit als Kompensationsmechanismus fungiert. Unsere Arbeitsgruppe überprüft diese Hypothese anhand eines Mausmodells mit transgener Überexpression des Na+-Ca2+ Austauschers. Die Ergebnisse tragen wesentlich zum Verständnis der Mechanismen bei, die zu einer gestörten Ca2+-Regulation bei Diabetes mellitus führen, und können möglicherweise neue Therapieansätze aufzeigen.
Reuter H, Seuthe K, Korkmaz Y, Gronke S, Hoyer DP, Rottlaender D, Zobel C, Addicks K, Hoyer J, Grimminger P, Brabender J, Wilkie TM and Erdmann E. The G protein Gα11 is essential for hypertrophic signalling in diabetic myocardium. Int J Cardiol 2013; 167(4): 1476-85.
Hoyer DP, Groenke S, Frank KF, Addicks K, Wettschureck N, Offermanns S, Erdmann E and Reuter H. Diabetes-related defects in sarcoplasmic Ca2+ release are prevented by inactivation Gα11 and Gαq in murine cardiomyocytes. Mol Cell Biochem 2010; 341: 235–44.
Reuter H, Gronke S, Adam C, Ribati M, Brabender J, Zobel C, Frank KF, Wippermann J, Schwinger RH, Brixius K and Muller-Ehmsen J. Sarcoplasmic Ca2+ release is prolonged in nonfailing myocardium of diabetic patients. Mol Cell Biochem. 2008; 308: 141-9.
Reuter H, Adam C, Grönke S, Zobel C, Frank KF, Müller-Ehmsen J, Brabender J and Schwinger RH. The increased angiotensin II (type 1) receptor density in myocardium of type 2 diabetic patients is prevented by blockade of the renin-angiotensin system. Diabetologia 2006; 49: 3067-3074.
Reuter H, Pott C, Goldhaber JI, Henderson SA, Philipson KD and Schwinger RH. Na(+) -Ca2+ exchange in the regulation of cardiac excitation-contraction coupling. Cardiovasc Res 2005; 67: 198-207.
Reuter H, Han T, Motter C, Philipson KD and Goldhaber JI. Mice overexpressing the cardiac sodium-calcium exchanger: defects in excitation-contraction coupling. J Physiol. 2004; 554: 779-789.
Reuter H and Philipson KD. Sodium-calcium exchanger overexpression in the heart -insights from a transgenic mouse model. Basic Res Cardiol 2002; 97: I31-35.
Reuter H, Henderson SA, Han T, Mottino GA, Frank JS, Ross RS, Goldhaber JI and Philipson KD. Cardiac excitation-contraction coupling in the absence of Na+-Ca2+ exchange. Cell Calcium 2003; 34: 19-26.
Reuter H, Henderson SA, Han T, Ross RS, Goldhaber JI and Philipson KD. The Na+-Ca2+ exchanger is essential for the action of cardiac glycosides. Circ Res 2002; 90: 305-308.
Regan TJ, Ahmed S, Haider B, Moschos C and Weisse A. Diabetic cardiomyopathy: experimental and clinical observations. N J Med 1994; 91: 776-778.


