- Startseite
- Forschung
- Immunzellantwort in kardiovaskulären Erkrankungen
- Cluster für Biologie des Leukozyten
- Cluster Wachstumsfaktoren des pulmonal-vaskulären Remodellings
- Immunzellantwort in kardiovaskulären Erkrankungen
- Inflammation im Rahmen der Herzinsuffizienz
- Strukturelle Herzerkrankung
- Klinische Kardiologie und Intensivmedizin
- Arbeitsgruppe Herzinsuffizienz
- Kardiale Zellersatz- & translationale Herzinsuffizienztherapie
- Elektrophysiologie
- Kontraktionskopplung und Calcium-Signaling
- Kardiovaskuläre Epidemiologie des Alterns
Immunzellantwort in kardiovaskulären Erkrankungen
Die Neven-DuMont-Stiftung geförderte Arbeitsgruppe zur experimentellen Kardiologie des Alterns befasst sich mit Immunzellantworten in kardiovaskulären Erkrankungen.
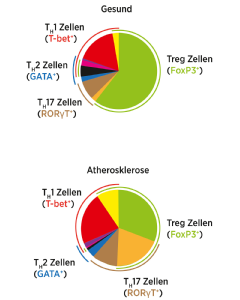
Atherosklerose, die Grundlage von Herzinfarkten und Schlaganfällen, bezeichnet die chronische Entzündung großer und mittelgroßer Arterien. Diese wird ausgelöst durch Ablagerung von Lipiden, Endothelaktivierung und nachfolgender Einwanderung von Immunzellen in die Gefässwand. Bereits gesunde Menschen und Mäuse weisen CD4 T Zellen auf, welche auf eine Strukturkomponente des LDL-cholesterins reagieren. Dabei sind diese Zellen regulatorischer Ausprägung (FoxP3+ Tregs). In atherosklerotischen Individuen akquirieren diese Zellen jedoch Koexpression von Transkriptionsfaktoren wie T-bet und RORyt, welche typischerweise pro-atherosklerotische T Zellsubtypen markieren (siehe Abbildung). Hier soll untersucht werden, welche Signale diesen Funktionswechsel der Zellen bedingen. Die Impfung mit den LDL-Strukturkomponenten verringerte erfolgreich Atherosklerose Mäusen. Die Translation auf den Menschen ist jedoch noch weit entfernt. Um diesem Ziel etwas näher zu kommen, wird sich die Arbeitsgruppe mit T Zellantworten in der frühen Phase der Atherosklerose beschäftigen, um ein optimales therapeutisches Fenster zu ermitteln. Ein spezielles Augenmerk wird dabei auf diese Immunzellen von Kindern mit erhöhtem Risiko gelegt. Die Arbeitsgruppe wird sich weiterhin mit neuen therapeutischen Strategien zur Abmilderung eines Herzinfarkts beschäftigen. Mehrere Immunzellpopulation residieren im Herzen, darunter auch unterschiedliche Makrophagenpopulationen. Diese Zellen spielen eine essentielle Rolle in der Entzündungsreaktion des Herzinfarkts sowie bei der Geweberegenerierung nach Infarkt. Kürzlich wurde eine neue Klasse an Rezeptoren auf der Oberfläche von Makrophagen nachgewiesen. Dabei konnte die Makrophagenfunktion anhand der Aktivierung oder Inhibierung dieser Rezeptoren modifiziert werden. Die Modulation dieser Rezeptoren könnte eine neue, attraktive Behandlungsmethode zur Regenerationsförderung des Herzmuskels nach erfolgtem Infarkt darstellen.
Weiterhin ist die Arbeitsgruppe mit einem Teilprojekt, welches gemeinsam mit Prof. Stephan Baldus geleitet wird, im transregionalen Sonderforschungsbereich TRR 259 „Aortenerkrankungen“ vertreten. Das Forschungsvorhaben hat zum Ziel Myeloperoxidase, vermittelte postranslationale Modifikationen der Marfan-Erkrankung aufzudecken.
The role of macrophage activation via olfactory receptor 2 in myocardial infarction
Weiterhin ist die Arbeitsgruppe mit einem Teilprojekt Graduiertenkolleg Cologne Cardiovascular Research Center (CCRC) GRK2407 „Inflammatory and cellular stress signaling: Switches to vascular dysfunction“ vertreten. Das Forschungsvorhaben hat zum Ziel im Rahmen des Gesamtkonzepts des CCRC die Aktivierung von Makrophagen über den olfaktorischen Rezeptor 2 im Myokardinfarkt genauer zu untersuchen.
2019
McArdle S, Buscher K, Ghoseh Y, Pramod AB, Miller J, Winkels H, Wolf D, Ley K (2019) Migratory and Dancing Macrophage Subsets in Atherosclerotic Lesions. Circ Res125:1038–1051
Bianchini M, Duchene J, Santovito D, Schloss M, Evrard M, Winkels H, Aslani M, Mohanta SK, Horckmans M, Blanchet X, Lacy M, von Hundelshausen P, Atzler D, Habenicht A, Gerdes N, Pelisek J, Guan Ng L, Steffens S, Weber C, Megens RTA (2019) CD274/PD-L1 marks non-classical monocytes to unveil new features of their origin and immunoregulatory function. Sci Immunol 4(36)
Seijkens TTP, Poels K, Meiler S, van Tiel CM, Kusters PJH, Reiche M, Atzler D, Winkels H, Tjwa M, Poelman H, Sluetter B, Kuiper J, Gijbels M, Kuivenhoven JA, Matic LP, Paulsson-Berne G, Hedin U, Hansson GK, Nicolaes GAF, Daemen MJAP, Weber C, Gerdes N, de Winther MPJ, Lutgens E (2019) Deficiency of the T cell regulator CBL-B aggravates atherosclerosis by inducing CD8+ T cell-mediated macrophage death. Eur Heart J. 40(4):372-382
2018
Kobijama K, Vassallo M, Mitzi J, Winkels H, Kimura T, Miller J, Wolf D, Ley K (2018) A clinically applicable adjuvant for an atherosclerosis vaccine. Eur J Immunol. 2018 48(9):1580-1587
Kimura T*, Kobiyama K*, Winkels H*, Tse K, Miller J, Vassallo M, Wolf D, Ryden C, Orrechioni M, Dileepan T, Jenkins MK, James EA, Kwok WW, Hanna DB, Kaplan RC, Strickler HD, Durkin HG, Kassaye SG, Karim R, Tien PC, Landay AL, Gange SJ, Sidney J, Sette A, Ley K (2018) Regulatory CD4+ T cells Recognize Major Histocompatibility Complex Class II Molecule-restricted Peptide Epitopes of Apolipoprotein B. Circulation. 138(11):1130-1143 *These authors contributed equally.
Winkels H*, Ehinger E*, Vassallo M, Buscher K, Dinh HQ, Kobiyama K, Hamers AAJ, Cochain C, Vafadarnejad E, Saliba AE, Zernecke A, Pramod AB, Ghosh AK, Anto Michel N, Hoppe N, Hilgendorf I, Zirlik A, Hedrick CC, Ley K’, Wolf D’. Atlas of the Immune Cell Repertoire in Mouse Atherosclerosis Defined by Single-Cell RNA-Sequencing and Mass Cytometry. Circ Res 122(12):1675-1688 *,‘These authors contributed equally.
Cochain C, Vafadarnejad E, Arampatzi P, Pelisk J, Winkels H, Ley K, Wolf D, Saliba AE, Zernecke A (2018) Single-cell RNA-seq Reveals the Transcriptional Landscape and Heterogeneity of Aortic Macrophages in Murine Atherosclerosis. Circ Res 122(12):1661-1674
2017
Winkels H, Meiler S, Lievens D, Engel D, Spitz C, Bürger C, Beckers L, Dandl A, Reim S, Ahmadsei M, Hartwig H, Holdt LM, Hristov M, Megens RTA, Schmitt MM, Biessen EA, Borst J, Faussner A, Weber C, Lutgens E, Gerdes N (2017) CD27 co-stimulation increases the abundance of regulatory T cells and reduces atherosclerosis in hyperlipidaemic mice. Eur Heart J 38(48):3590-3599.
Winkels H*, Meiler S*, Smeets E*, Lievens D, Engel D, Spitz C, Bürger C, Rinne P, Beckers L, Dandl A, Reim S, Ahmadsei M, Van den Bossche J, Holdt LM, Megens RT, Schmitt M, de Winther M, Biessen EA, Borst J, Faussner A, Weber C, Lutgens E, Gerdes N. CD70 limits atherosclerosis and promotes macrophage function. Thromb Haemost117(1):164-175 *These authors contributed equally.
2016
Meiler S, Smeets E, Winkels H, Shami A, Pascutti MF, Nolte MA, Beckers L, Weber C, Gerdes N, Lutgens E. Constitutive GITR Activation Reduces Atherosclerosis by Promoting Regulatory CD4+ T cell Responses (2016) Arterioscler Thromb Vasc Biol 36(9):1748-52
2013
Lievens D, Habets KL, Robertson AK, Laouar Y, Winkels H, Rademakers T, Beckers L, Wijnands E, Boon L, Mosaheb M, Ait-Oufella H, Mallat Z, Flavell RA, Rudling M, Binder CJ, Gerdes N, Biessen EA, Weber C, Daemen MJ, Kuiper J, Lutgens E (2013) Abrogated transforming growth factor beta receptor II (TGFβRII) signalling in dendritic cells promotes immune reactivity of T cells resulting in enhanced atherosclerosis. Eur Heart J34(48):3717-27

